
Cours de chimie Organique - G. Dupuis - Lycée Faidherbe de Lille
LES ETHERS
Nomenclature
Éthers non cycliques
On appelle éther un composé dans lequel un atome d'oxygène est lié par
liaison simples à deux groupes organiques différents. Les éthers simples
sont nommés comme des alkoxyalcanes. La nomenclature radico-fonctionnelle est
encore largement utilisée surtout pour les éthers les plus simples. A ces noms
systématiques, il convient d'ajouter les noms usuels. Ainsi l'éthoxyéthane
est appelé couramment éther ordinaire.

|
I |
II |
III |
IV |
|
Méthoxyméthane |
Méthoxyéthane |
Ethoxyéthane |
2-Méthoxypropane |
|
Oxyde de diméthyle |
Oxyde de méthyle et d'éthyle |
Oxyde de diéthyle |
Oxyde de méthyle et de 2-méthyléthyle |
Ethers cycliques
Le nom de base est celui du cyclane. Les atomes d'oxygène qui remplacent
ceux de carbone dans le cycle sont indiqués par oxa.

|
I |
II |
III |
IV |
|
oxacyclopropane |
oxacyclopentane |
oxacyclohexane |
1,4-dioxacyclohexane |
|
oxyde d'éthène |
tétrahydrofurane (THF) |
tétrahydropyrane (THP) |
dioxane |
Les éthers possèdant trois chaînons sont nommés oxacyclopropanes. Ils sont aussi appelés plus couramment des époxydes. Leur réactivité est beaucoup plus grande que celle des autres éthers et on leur consacrera un paragraphe spécial.
Propriétés physiques
Caractéristiques géométriques et énergétiques
L'atome d'oxygène des éthers contracte deux liaisons simples avec les
atomes de carbone des groupes organiques liés. Il reste donc deux paires d'électrons
non liantes sur l'atome d'oxygène. La géométrie localement plane autour de
l'atome d'oxygène dérive d'un arrangement tétraédrique des paires d'électrons.
Puisque les paires non liantes occupent en moyenne un volume plus grand que les
paires liantes, on prévoit un angle entre les liaisons supérieur à celui
observé dans un tétraèdre régulier c'est à dire a
>109°28'. Le tableau suivant regroupe quelques valeurs moyennes de grandeurs géométriques
et énergétiques. Remarquons la valeur élevée de l'énergie de dissociation
de la liaison C-O.
|
d (C-O) (nm) |
a (COC) (°) |
D0 (C-O) (kJ.mol-1) |
|
0,141 |
118 |
343 |
La présence de l'atome d'oxygène plus électronégatif (3,5 dans l'échelle de Pauling) que les atomes de carbone (2,5) et d'hydrogène (2,1) ainsi que la géométrie de la molécule sont à l'origine d'un moment dipolaire permanent pour la molécule de la plupart des éthers.
|
Ether |
Constante diélectrique er |
Moment dipolaire m (D) |
|
Ethoxyéthane |
4,2 |
1,25 |
|
Tétrahydrofurane |
7,4 |
1,70 |
Certains éthers comme le dioxane ne possèdent pas de moment dipolaire permanent car les moments dipolaires de liaison se compensent. L'absence de liaison H entraîne des températures de changement d'état plus faibles que celles des alcools de même masse molaire.
|
Nom |
TF (°C) |
TE (°C) |
|
Méthoxyméthane |
-138,5 |
-23 |
|
Ethoxyéthane |
-116,62 |
34,5 |
Les composés cycliques ont des points d'ébullition plus élevés que les non cycliques. En effet, leur structure plus compacte permet des interactions de Van der Waals plus importantes entre les molécules.
Spectroscopie infrarouge
On distingue les éthers non cycliques, les éthers
cycliques et dans cette famille les époxydes. Les valeurs suivantes
correspondent aux éthers non cycliques.
|
Vibration |
C-O-C (asym) |
C-O-C (sym) |
|
Nombre d'onde (cm-1) |
1260-1070 (forte) |
1055-870 (forte) |
Le spectre infrarouge ci-dessous est celui du propyloxypropane.

Ethoxyéthane
|
L'éthoxyéthane est l'éther le plus utilisé comme solvant. Il est peu toxique . Il est très volatil (TE = 34,6 °C) et extrêmement inflammable comme en témoigne un point éclair très bas (PE = -40°C ). Il a été utilisé comme anesthésique. On peut l'obtenir par déshydratation intermoléculaire de l'éthanol en présence d'acide sulfurique à 130-140 °C.
|
MTBE
|
Le méthyléthyloxyméthane (MTBE) est obtenu par réaction entre le méthylpropène et le méthanol.
|
THF
|
Le tétrahydrofurane est un éther très utilisé comme solvant en synthèse. Il a une température d'ébullition plus grande que l'éthoxyéthane (TE = 67 °C). Il est narcotique et toxique . On peut l'obtenir par déshydratation du butan-1,4-diol. Il est difficile de le conserver sec car il est assez miscible avec l'eau.
|
Dioxane
|
Le dioxane est utilisé comme solvant en synthèse organique. Il possède une température d'ébullition assez élevée. A la température ordinaire c'est un liquide huileux (TF = 11 °C, TE = 101,3 °C). C'est un composé toxique. On peut l'obtenir par déshydratation intermoléculaire de l'éthylèneglycol sous l'action de l'acide sulfurique.
|
|
On l'obtient industriellement par réaction entre l'éthène et le dioxygène à 170 °C en présence d'Ag comme catalyseur. A la température ordinaire c'est un liquide (TE = 12,5 °C). C'est un composé très réactif toxique.
Il est très utilisé comme intermédiaire en synthèse organique car il peut être ouvert sous l'action d'un grand nombre de réactifs. |
Utilisation des éthers en tant que solvants au laboratoire
Séchage des éthers
Les éthers peuvent contracter des liaisons H avec l'eau ou les alcools avec
lesquels ils sont miscibles dans une certaine proportion. L'utilisation de réactifs
incompatibles avec l'eau même à l'état de traces comme les organométalliques
pose le problème du séchage des éthers. Le THF est beaucoup plus miscible à l'eau que l'éther
ordinaire. Son séchage revêt
une importance particulière en synthèse organique.
On distingue plusieurs étapes selon la quantité d'eau présente dans l'éther :
|
|
Les zéolithes naturelles ont été découvertes en 1756, leur nom vient de pierre qui bouillent car elles bouillonnent quand on les chauffe. Elles peuvent servir à séparer les constituants d'un mélange par piégeage de molécules comme l'eau dans les cavités, d'où leur nom de tamis moléculaire. La photographie de gauche représente des tamis moléculaires dont les cavités font 0,4 nm. Ils sont utilisés pour le séchage des liquides organiques. On peut conserver les éthers sur ce type de tamis placé au fond de la bouteille. |
Extraction
par solvant
L'éthoxyéthane est souvent utilisé comme solvant d'extraction car il
dissout de nombreuses matières organiques et il est facile à éliminer. Un
appareil simple utilisé pour les extractions liquide-liquide est l'ampoule à décanter.
|
|
L'ampoule à décanter est utilisée pour l'extraction liquide-liquide. La solution S contenant le composé à extraire et le solvant d'extraction S (par exemple l'éther) sont introduits dans l'ampoule. Le composé à extraire A se partage entre les deux solvants selon un équilibre qu'on peut schématiser par l'équation :A(S) = A(S )Le rapport :K = [A( S )]/[A(S)]s'appelle coefficient de partage. A une température donnée, c'est une constante. L'extraction est d'autant plus complète que K est plus grand. Pour extraire la quantité maximale de composé d'une solution on a intérêt à procéder en plusieurs étapes. On réalise des extractions successives avec plusieurs fractions de solvant. Les phases organiques sont ensuite combinées. |
Les photographies ci-dessous représentent l'extraction du b - carotène d'une solution aqueuse par l'éthoxyéthane.
|
|
|
Photographie II : la phase organique constituée de b -carotène dans l'éther constitue la phase supérieure. La phase aqueuse qui ne contient presque plus de carotène constitue la phase inférieure. Ces phases se sont distribuées dans cet ordre par décantation. Elles peuvent ensuite être séparées avec précision grâce à la forme particulière de la partie terminale de l'ampoule. |
|
I |
II |
|
Elimination du solvant
Un des avantages de l'éther comme solvant d'extraction est qu'il peut être
éliminé rapidement du fait de sa grande volatilité. Un appareil couramment
utilisé pour éliminer le solvant d'une solution est l'évaporateur rotatif
(appelé souvent "rotavapor"). Le mélange de solvant et de soluté
est placé dans le ballon de droite. Ce dernier est plongé dans un bain-marie.
Il est incliné et animé d'un mouvement de rotation de manière à accroître
la surface d'évaporation du solvant. La pression à l'intérieur du dispositif
est abaissée au moyen d'une trompe à eau ce qui augmente la vitesse d'évaporation.

Ces opérations doivent être réalisées en l'absence de toute flamme et de toute étincelle en raison de la grande inflammabilité de l'éther.
Basicité
Lewis
L'existence de doublets non liants sur l'atome d'oxygène entraîne une réactivité
basique au sens de Lewis.
|
Avec BF3 on obtient un complexe stable : l'éthérate de trifluorure-bore.
|
Ce caractère basique se manifeste vis à vis des organométalliques comme les magnésiens. Dans ce cas plusieurs équilibres tels que l'équilibre de Schlenk peuvent intervenir simultanément.
Les éthers tels que Et2O manifestent des propriétés complexantes vis à vis de composés des éléments de transition.
|
|
En ajoutant quelques gouttes d'une solution aqueuse de peroxyde d'hydrogène H2O2 (1 M) à une solution de dichromate de potassium K2Cr2O7 (1 M) acidifiée par H2SO4, on obtient de façon fugace une coloration bleue. En ajoutant de l'éthoxyéthane au mélange la coloration se stabilise. Après décantation, la phase éthérée est bleue. Elle contient un composé peroxo du chrome complexé par l'éther : [CrO(O2)2Et2O]. Remarque : les composés du Cr (VI) sont dangereux (cancérigène). Porter des gants pour manipuler ces composés et travailler sous une hotte ventilée. |
Brönsted
Les éthers sont aussi des bases de Brönsted très faibles. Leurs acides
conjugués constituent des sels d'oxonium qui sont des acides forts : pKa (R2OH+/R2O)
# -3,5.
Coupure C-O
Action des acides
Les éthers, autres que les époxydes, sont stables en milieu basique (sauf,
en présence de bases très fortes comme les organolithiens). En revanche, la
liaison C-O peut être rompue en milieu acide, notamment par les acides
halohydriques. Un réactif utile pour couper les éthers est HI qui les clive dès la température ambiante. Son rôle est double : H+
protone l'oxygène ce qui améliore considérablement son aptitude nucléofuge
et I-, qui est un bon nucléophile, induit la coupure de la liaison
C-O en réalisant une substitution nucléophile.
HBr coupe les éthers vers 100 °C et HCl à une température encore plus élevée car les anions sont de moins en moins nucléophiles.
Lorsque l'atome de carbone impliqué dans la fonction éther est plus substitué, on peut observer des substitutions de type SN1 qui s'accompagnent alors d'un certain pourcentage d'élimination.
|
L'oxyde de ditertiobutyle est instable en milieu acide à cause de la répulsion des groupes méthyle. Comme la réaction passe par l'intermédiaire d'un carbocation, on obtient aussi une proportion non négligeable de méthylpropène par élimination.
|
Utilisation des éthers comme groupes protecteurs
Du fait de leur faible réactivité, les éthers sont largement utilisés
comme groupement protecteur des fonctions alcool et phénol. L'anisole est un éther
souvent utilisé pour protéger la fonction phénol lors de réactions sur le
cycle benzénique. Il est clivé en phénol et iodure de méthyle, sous l'action
de HI, par une réaction de type SN2 qui implique l'atome de carbone
du méthyle.

Notons que dans cette réaction on n'obtient pas PhI et CH3OH. On sait en effet que les réactions de substitutions nucléophiles sur les cycles aromatiques non désactivés ne se produisent pas.
Réactions au voisinage de la fonction éther
Auto-oxydation
On sait depuis longtemps que les éthers laissés au contact de l'air en présence
de lumière peuvent conduire à des mélanges dangereusement explosifs.
La réaction entre l'éther et le dioxygène s'appelle auto-oxydation. Elle conduit à la formation d'hydroperoxydes. Ils peuvent exploser sous l'action d'une élévation de température, ou d'un choc.

Avant de distiller un éther il est impératif de vérifier l'absence d'hydroperoxydes. Ces composés sont moins volatils que l'éther du fait d'une masse molaire plus grande et ils ont tendance à se concentrer dans le ballon au cours de la distillation. Lorsque leur concentration a atteint une valeur critique, ils peuvent être à l'origine d'explosions très violentes.
|
|
Un test simple consiste à faire réagir la solution dans laquelle on soupçonne la présence d'hydroperoxyde avec une solution de KI (mélanger 0,5 mL d'éther, 1 mL de KI à 10 % et 0,5 mL d'acide éthanoïque. Agiter. En présence de peroxydes la solution devient brune car I- est oxydé en I2 qui forme avec I- l'ion I3- . L'expérience a été réalisée du THF provenant d'une bouteille entamée depuis quelques mois. Pour rendre le test plus sensible, on peut ajouter quelques gouttes d'un indicateur d'iode (empois d'amidon ou Thiodène). Dans ce cas la solution devient bleue. |
Halogénation
La réaction avec Cl2 de type radicalaire, permet de substituer
l'atome d'hydrogène porté par le C en a de l'atome
d'oxygène par un atome de chlore.

Les a - halogénoéthers sont des composés intéressants car l'atome de chlore est rendu mobile par sa proximité avec l'atome d'oxygène. Il peut être substitué par une assez grande variété de nucléophiles. La préparation du 2-hydroxypyrane qui intervient dans la synthèse du dihydropyrane (DHP) illustre cette propriété.

Le 2-hydroxypyrane conduit au DHP par élimination d'eau en milieu acide.
Élimination
Sous l'action de bases très fortes comme les organosodiques ou les
organolithiens et dans une moindre mesure les organomagnésiens, l'atome
d'hydrogène porté par le carbone en b de l'oxygène
peut être arraché. Une réaction d'élimination conduit à un alcène et à un
alcoolate.
![]()
Époxydes
Introduction
Synthèse des époxydes
A partir des composés éthyléniques
A partir du (Z)-but-2-ène comme substrat, on obtient le (cis)-2,3-diméthyloxacyclopropane. La réaction est stéréosélective.

Réalisée à partir du (E)-but-2-ène, la réaction conduit à un mélange racémique d'époxydes énantiomères.

Puisque deux stéréoisomères donnent des produits eux-mêmes stéréoisomères. La réaction est stéréospécifique de stéréochimie syn.
A partir des composés carbonylés
Le réactif est un ylure de soufre. Cette réaction dite de Corey-Chaykovsky
a acquis une grande importance en synthèse organique du fait de sa stéréosélectivité.
Ouverture des époxydes
Ouverture nucléophile
La réaction est régiosélective. Le nucléophile attaque l'époxyde sur
l'atome de carbone le plus dégagé donc le moins substitué. Si le cas se présente,
on observe une inversion de configuration de cet atome. La réaction est du type
SN2. Les réactions suivantes sont particulièrement utiles en synthèse
:
![]()
![]()

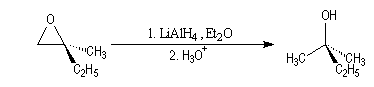

Ouverture en milieu acide
Si les atomes de carbone sont substitués de façon différente : par
exemple un carbone primaire et un carbone tertiaire, la réaction est régiosélective.
L'attaque du nucléophile s'effectue en général sur l'atome de carbone qui
stabilise le mieux une charge positive c'est à dire dans l'exemple ci-dessous,
sur l'atome de carbone substitué par le plus grand nombre de groupes alkyles
(la réaction ressemble à une SN1).

Ethers couronnes
Préparation

Un éther-couronne peut être caractérisé par le nombre m de chaînons du cycle et le nombre n d'atomes d'oxygène.
|
Attention : les éthers couronnes sont des composés toxiques en raison de leur action sur le système nerveux. Ils doivent être manipulés avec précaution. Il faut porter des gants et travailler sous une hotte ventilée. |
Ethers d'énols
L'exemple du dihydropyrane (DHP)
Les éthers d'énols sont des composés bifonctionnels qui combinent la
fonctionnalité éther avec une insaturation en a de
l'atome d'oxygène. Le dihydropyrane est un réactif utile facile à préparer
et de coût peu élevé.
|
Le DHP peut être obtenu à partir du 2-hydroxypyrane par une réaction d'élimination en milieu acide.
|
La double liaison éthylénique est enrichie en électrons car la présence de l'atome d'oxygène permet une délocalisation électronique comme en témoignent les formes mésomères suivantes :

Utilisation du DHP comme groupement protecteur
Les réactions suivantes illustrent l'utilisation de DHP comme groupe
protecteur dans une synthèse magnésienne :





Ethers de silyle
Synthèse
|
Liaison |
C-O |
Si-C |
Si-O |
|
D0 (kJ.mol-1) |
343 |
372 |
531 |
La force motrice de la réaction suivante vient de la différence entre l'énergie de la liaison Si-O et celle de la liaison C-O.

Utilisation comme groupes protecteurs
Ethers d'énols silylés
Préparation
Les éthers d'énols silylés sont des intermédiaires de réaction qui ont
acquis une grande importance dans les réactions organiques modernes. On peut
les obtenir en effectuant la réaction entre le composé carbonylé et le
chlorure de triméthylsilyle en présence de Et3N. Un réactif
permettant d'effectuer la réaction dans des conditions très douces est
l'iodure de triméthylsilyle en présence de (Me3Si)2NH.
Ethers d'intérêt biologiques
Certains composés d'intérêt biologique comportent une fonction éther associée ou non à d'autres fonctions.
Thyroxine
|
|